掲載開始日:2022年10月17日更新日:2023年11月14日
ここから本文です。
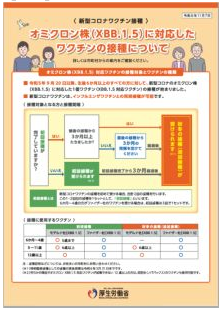
乳幼児(6か月~4歳)の新型コロナワクチン接種について
リーフレット:厚生労働省作成
|
【表面】 |
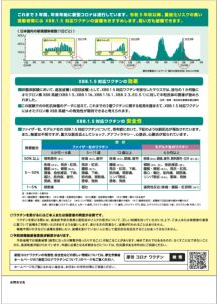
【裏面】
公益社団法人日本小児科学会資料令和4年11月2日、公益社団法人日本小児科学会が「生後6か月以上5歳未満の小児への新型コロナワクチン接種に対する考え方」を公表されています。詳細については、以下のリンクから御確認ください。
接種を受けられる期間令和6年3月31日まで 使用するワクチン・接種の対象・接種回数・接種間隔・用法用量
通常、三角筋中央部又は大腿前外側部に接種します。1歳未満は、大腿前外側部に筋肉内接種します。(臀部には接種しません。) 接種を受けるための流れ
接種の有効性・安全性詳しくは、厚生労働省の「新型コロナワクチンの有効性・安全性について(外部サイトへリンク)」のページをご覧ください。 副反応について
健康被害救済制度についてワクチン接種の副反応による健康被害が生じた場合、その健康被害が接種を受けたことによるものであると厚生労働大臣が認定したときには給付を受けることができます(健康被害救済制度)。 Q&A
お問い合わせ福祉保健部薬務感染症対策課 薬務対策室 〒880-8501 宮崎県宮崎市橘通東2丁目10番1号 電話:0985-26-7060 ファクス:0985-26-7336 | ||||||||||||||||||||||||||||||